fda经验启示 | 改革药品注册收费制度,进一步深化审评能力建设 -龙8体育
发布时间:2024-03-22
文章来源:政策研究中心
2015年以来,在“创新驱动发展战略”的指引下,国家药品监管部门始终坚持“以患者为中心”“以临床价值为导向”,不断提高审评能力和效率为落脚点,打破了仿制为主与创新发展不相适应的困境,构建了科学高效的审评机制,旨在为创新各个环节提供支持要素。通过一系列改革措施,中国药品审评审批体系无论从审评可预期性角度,还是审评创新药能力角度均有极大提升,进入了收获期。一大批国内外创新产品相继上市,不仅解决了审评积压问题,也解决了过去中国创新药“从无到有”的产业发展诉求,中国创新能力和监管水平协同发力,均已经迈入国际先进行列。
当前,我国已经进入从制药大国向制药强国跨越的关键时期,这也就意味着审评能力建设应当朝向更高的目标奋进。本文拟通过学习先进国家审评体系建设经验并分析中国审评体系可借鉴之处,为未来我国审评能力提升提供思路。
一
fda加强新药审评能力建设经验
fda是全球最具权威的药品监管机构之一,但其并非先天的领先者,而是得益于1992年《处方药使用者付费法案》(the prescription drug user fee act, pdufa)的颁布实施,不断优化药品审评制度,并建立了一支规模庞大、素质较高的专家审评队伍,开创了其新药审评审批的新纪元,且直至今日,仍在更新使用当中。同时,在pdufa显著成效的基础上,美国国会又相继颁布了《生物类似药用户费用法案》《仿制药使用者付费法案》等用户费用法案,共同支持fda绩效改善和能力提升。
1.pdufa法案设计之初即聚焦于支持新药审评
上世纪90年代,美国存在着严重的“药品上市迟滞”(drug lag),新药在欧洲获批后数年才能在美国销售。据原美国药物研究与制造商协会资料显示,1992年之前70%的药物首先在美国境外获得批准,且平均审查时间长达29个月,这不仅使得患者无法及时获得最新的治疗药物,也影响企业研发成本的收回,给企业造成了额外的损失,据fda估计,每推迟一个月,企业将多花费1000万美元。在此背景下,美国国会首次批准了pdufa法案,授权fda向企业收取药品注册审评费用,据当时fda专员david kessler估计,该费用将帮助fda雇佣620名新员工,来提高新药审查效率。
实际上,fda多年来一直在向国会请求实施注册审评收费,但遭到制药行业普遍反对,因为产业认为这些资金可能无法全部用于加速新药审评,而是进入财政部帮助减少联邦债务。意识到行业并非反对收费本身,方案颁布之初便设立了四项立法前提:①用户费用作为fda基本拨款的补充;②用户费用专门用于药品和生物制品审评;③用户费用必须合理;④fda和国会必须做出药品与生物制品审评时间的长期承诺。
设立药品审评专项经费用于配备新药审查所需的资源是pdufa最成功的制度设计之一。从pdufa ⅵ期间(2017年)起,财政拨款支持新药审评占比下降到30%以下,用户费用占比超过75%,注册审评收费已经成为支撑fda审查工作的最主要资金来源。
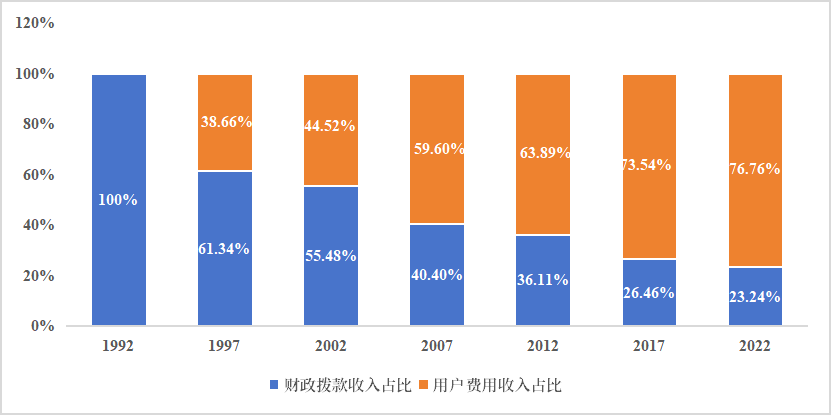
图1 fda支持药物审查活动资金来源
来源:pdufa财务报告、中国药促会整理
2.pdufa法案实施现状
① 及时回应产业发展诉求
设立到期届满“日落条款”(每5年国会将再次授权,除非得到再次批准,否则将就此失效)是pdufa另一重要的制度设计之一。1992年至今,法案已经历了七次重新授权,国会、产业界、fda共同对使用者付费项目药品监管审查活动的结果进行审查,及时调整和推进pdufa覆盖范围,加强审评队伍胜任力建设,使得fda在帮助关键新药能够及时推向市场并保持科学严谨性和坚持患者安全的高标准的同时,能够适应科学技术的进步与产业发展。
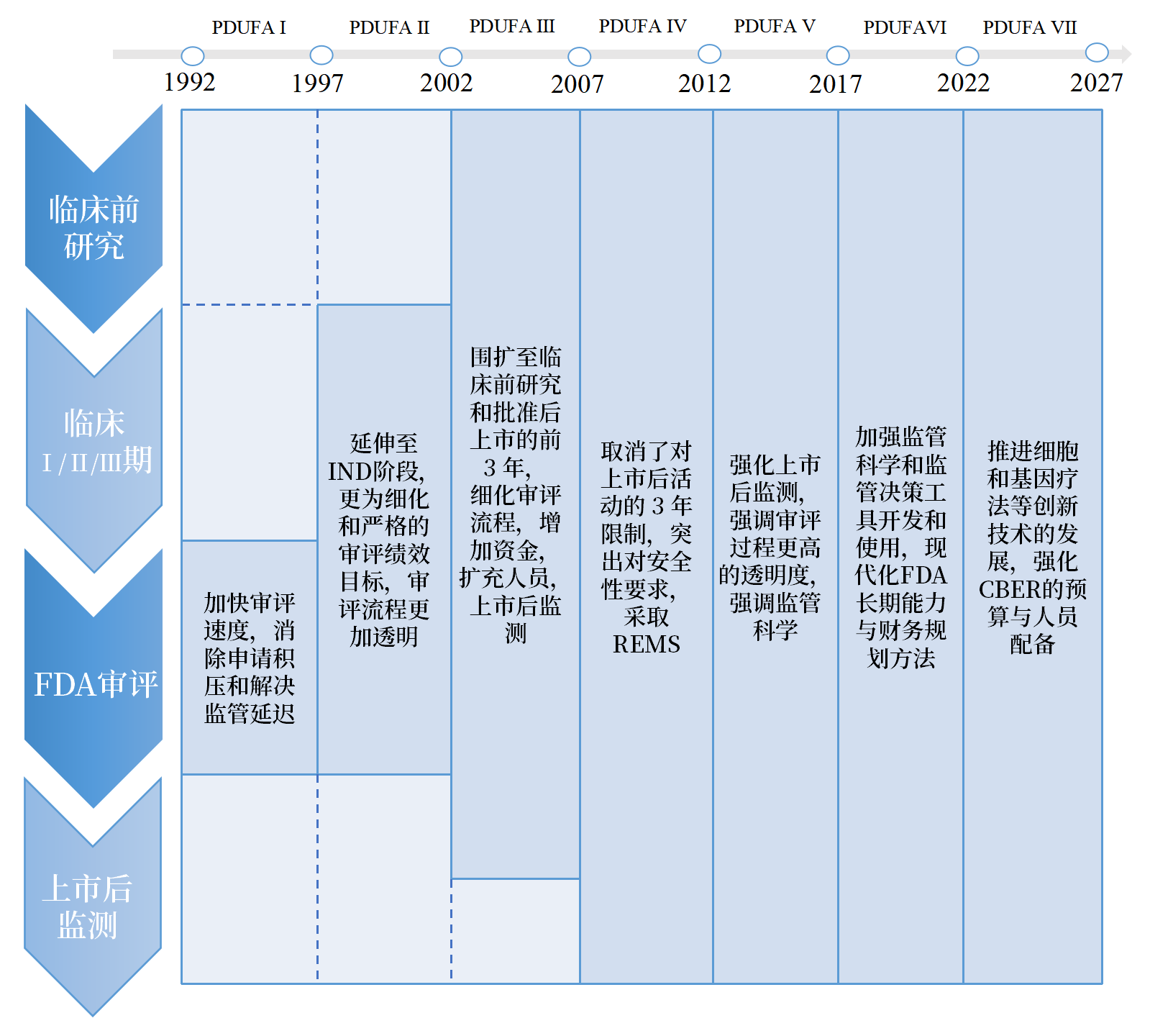
图 2 从pdufa ⅰ至pdufa ⅶ覆盖范围变迁
来源:pdufa承诺、中国药促会整理
② 充分落实了专项经费的价值
在国会、产业等共同监督下,fda充分落实了其法案设立初衷,加强审评资源配备,推动审评队伍建设,体现在以下几个方面。
实现了收支平衡。根据pdufa法案财报披露,一方面法案规定的财政拨款全部用于该财年的新药审评资源配备;另一方面,从pdufa ⅱ起,每财年注册审评收费资金用于加速审评的占比基本均超90%,尤其在pdufa ⅵ期间(2017-2022年)这一比例超过了96%。
充分运用于加强cder、cber建设。cder是fda药品审评工作的核心部门之一,承担了绝大多数药品审评工作,对fda各部门pdufa费用(包财政拨款和用户费用)支出的情况分析也发现,见下图3,近15年,cder使用了将近70%的资金。同时,虽然2007-2017年,cber资金支出占比呈现下降趋势,但随着基因、细胞疗法的蓬勃发展,增强cber的能力建设的重要性也日益凸显,从数据上来看,cber资金配额开始回升。
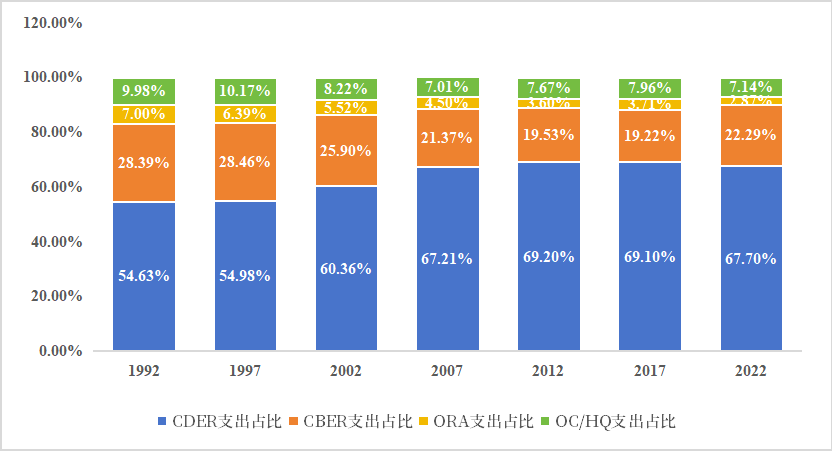
图3 fda各部门费用使用情况(包括:拨款和用户费用)
备注:ora,监管检查;oc/hq,行政管理等。
来源:pdufa财务报告、中国药促会整理
审评队伍是药品审评审批的技术支撑力量和实施主体,其建设关乎药品监管水平的高低,fda高度重视审查人员的激励,尤其是临床审评岗位。如下图4所示,从1993财年开始,用于药品审查人员的薪酬福利的用户费用的绝对值和占总体用户费用支出的比例迅速增长,到pdufa ⅱ至pdufa ⅴ期间基本维持在63%左右,pdufa ⅵ期间又增长至80%以上,达到了一个更高的水平范围,这是由于fda优化了支出金额统计结构,将人员聘用工资和pdufa支持的运营药品审查工作费用成本进行了合并统计,这些工作包括:核心监管审查职能、批准前检查、指导和政策制定活动等。
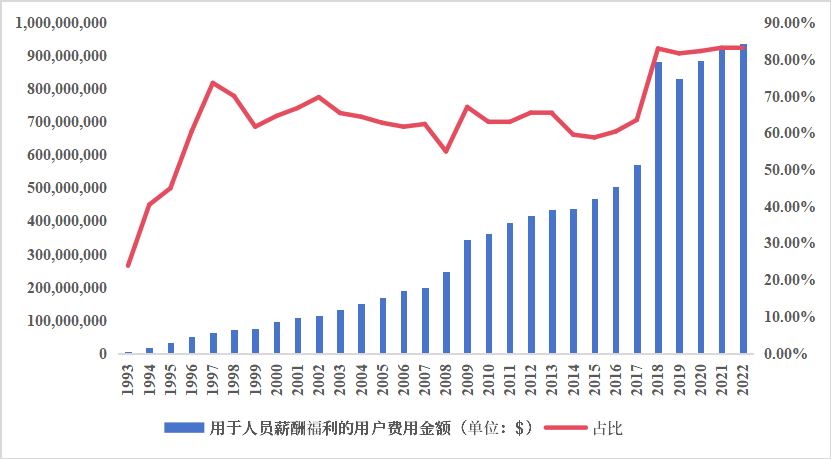
图4 用于支持药品审查人员薪酬福利的用户费用支出情况
来源:pdufa财务报告、中国药促会整理
根据federal pay统计,见下图5,2022年度fda年平均薪酬为133,236.28美元,包括基本工资和奖金两部分,其中144,000-160,000美元薪酬段人数最多,达到3943名员工,约占总人数的20%。同时,fda高度重视医学人才的吸引与激励,针对不同科室的医学人才设立了不同的奖金补贴计划,使其与各科室行业平均水平相适应或超行业平均水平,据federal pay 公示显示,fda收入最多的前100的员工中,64%为医学人员,收入水平最高的医学人员年薪酬高达400,000美元,超行业平均水平。
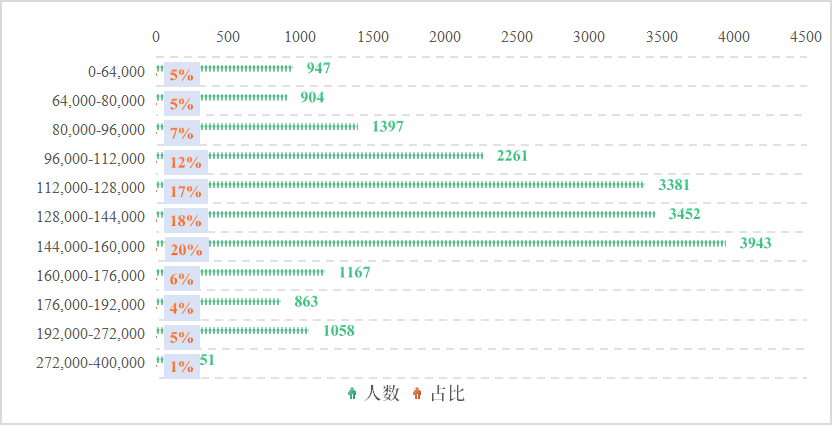
图5 2022年度fda不同薪酬人数分布情况(单位:$)
来源:federal pay、中国药促会整理
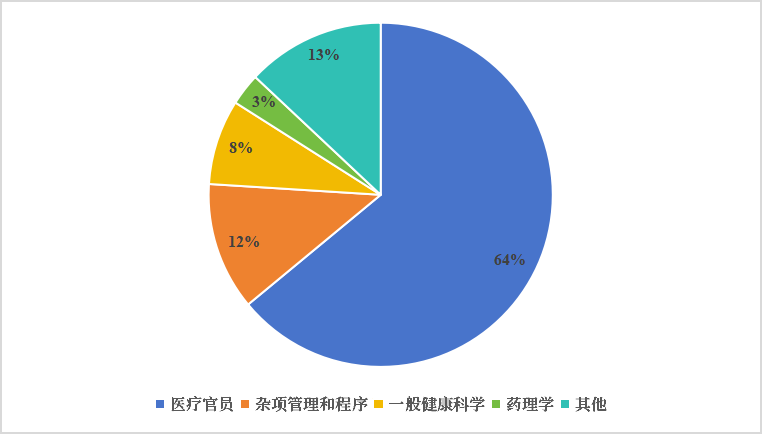
图6 2022年fda收入top 100的员工
来源:federal pay、中国药促会整理
3.fda药品监管审评能力得到了全方面的提升
① 建立起了一支高度专业化的审评队伍
fda不断加强审评队伍的建设与资源配备,以cder为例,据fda官员公开报告统计显示(图7),2022年cder共有超5000人的人员队伍,其中3000人左右属于科学家和专家,医学博士、药剂师、药理/毒理学家、化学家数量相当,共占据科学家和专家队伍的86.47%,形成了一支高度专业化的科学审评队伍。
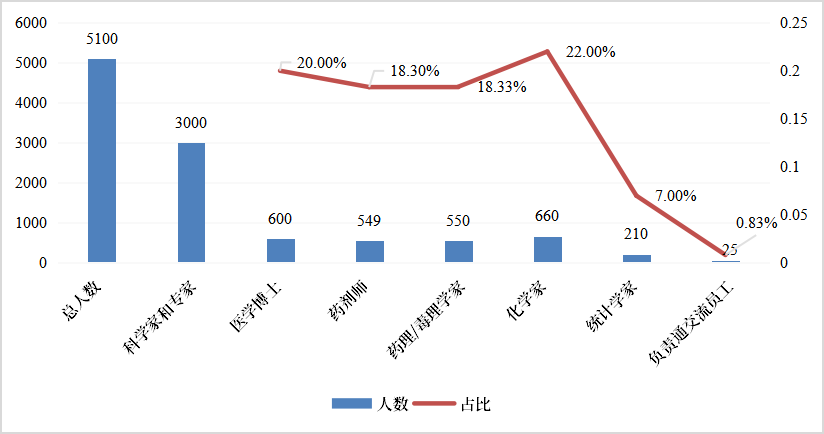
图7 2022年cder人才结构分布
来源:fda官方统计,同写意
② 审评工作效率及美国产业创新能力发生翻天覆地的变化
pdufa推出以来,极大地推进了fda新药审评效率的提升,成功扭转了“药品上市迟滞”的现象。首先,fda收到nda或bla申请数量均呈现上升趋势;标准审评中位时间稳定在10个月左右,90%优先审评中位时间为6个月左右;1993财年产业提交的nda或bla首轮批准通过率仅为28%,到pdufa ⅰ末(1997财年)提升至44%,至巅峰时期标准审评首轮批准通过率为62%,优先审评首轮批准通过率为85%,据《novel drug approvals for 2023》统计显示,2023年cder首轮批准通过率为84%。
在fda监管能力提升及与产业的相互作用中,美国产业的创新能力、创新质量也有了质的飞跃。如下图8所示,1992年以前,仅30%的医药创新发生在美国,到了近几年,fda每年批准的创新药中属于fda全球首批的新药占比均值超72%,巅峰时期高达86%;2015-2023年fda已累计批准fic 166个,fic批准占比呈现逐渐上升的趋势。
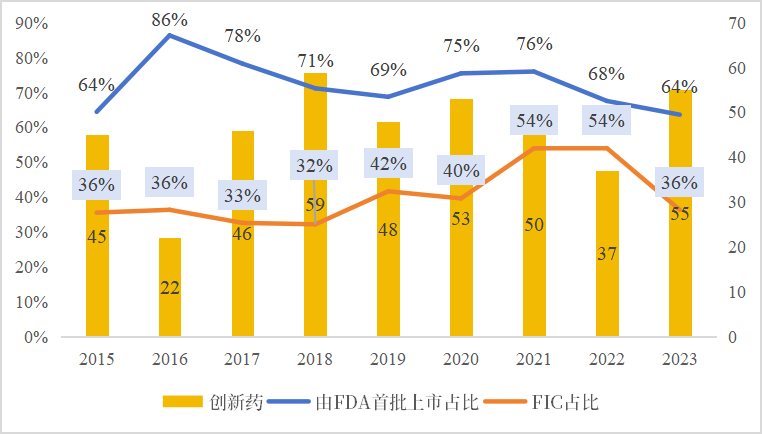
图 8 fda批准创新药情况
来源:fda《novel drug approvals》、中国药促会整理
③ 国会支持和公开透明是fda成功经验最重要的保障
美国国会对pdufa的支持不仅体现在审议和再授权每5年一次的修正法案,fda每财年均需向国会报告该年度法案的绩效实施和财务状况,受国会监督。同时,国会下设机构会开展独立的研究和评估。
关注监管政策和监管过程、结果的公开透明是fda取得卓越成效的另一重要法宝。首先,fda在多方监督和支持下制定公开药品审查绩效目标、监管能力提升建设目标并在实践中不断改进和细化;其次,fda定期发布绩效目标达成情况审查报告及财政拨款、用户费用收入使用情况财务报告。这些举措使得专项经费能够在阳光下运行,提高fda监管的科学性和灵活性的同时,减轻政策推行阻力。
二
加强中国药品监管能力建设的启示
fda实践证明,药品注册收费制度不是医药产业发展的负担,而是优化药品审评审批效率、加快新药上市、提高患者用药可获得性,同时支持产业可持续发展的重要政策手段。
当前,药品注册收费属于行政审批事项收费,即按照国家规定,申请人缴纳费用一律直接缴入国库,而国家药监局经费则由同级财政预算统筹安排,实行收支两条线,存在着两方问题。第一,收费标准与经济社会发展状况不协调。2015年调整后,已有近10年未曾上调注册费用,反观fda、ema、pmda等药品监管机构,则会每年根据通货膨胀率和审评工作量调整药品注册审评收费标准,来维持审评部门的高效运营,且均远超国内注册审评收费费用率。第二,“收支两条线”导致审评收费未充分用于药品审评。即从形式上来看,审评收费和审评所需消耗人力、物力费用无直接因果关系。且根据药审中心的决算报告分析发现,注册审评收费不仅在形式上“收支两条线”,在实际使用上也存在着巨大的收支不平衡。据药审中心年度预算报告显示,2020-2023年药审中心每年事业收入费用均不超过4亿元,实际药品注册审评收费远大于这一金额。
因此,国家应当支持并首先制定法律,明确将药品注册收费划归专项收入管理,同时建立公开透明的机制。如此,破除已有“收支两条线”模式,使得药审中心具有更充分的资源,在社会的监督下,根据审评任务量的变化和产业需求的变化,及时配备审评资源,增加审评队伍规模,加强内外部监管科学研究探讨,灵活寻求外部前沿专家专业资源。
其次,监管能力的建设在于人的管理,药审中心应当引入市场机制,建立多层次的审评人员薪酬待遇。当前审评中心由于较低的薪酬水平无法充分体现审评队伍的技术价值,对于机构外国内外高水平审评专家的吸引力不够,对于内部审评队伍的人才保留能力也面临着挑战。建议将现有的注册收费划入专项基金后,提高整体审评队伍的薪酬待遇并设立多样化的奖励机制,令其达到行业平均水平,并通过良好的薪酬待遇吸引并聘请国内外资深临床专家、药学专家、药理毒理专家等加入审评队伍,最终使得中心人力资源规模和人力资源专业化程度与中国医药创新产业的发展相适应,推动产业高质量可持续发展。
审核:张志娟
参考文献:fda历年绩效报告、财务报告
声明:本文内容仅提供信息性参考,不构成具体市场投资建议,也不可直接作为决策内容,中国医药创新促进会不对任何主体因使用文中内容所导致的任何损失承担责任。
原文链接:https://mp.weixin.qq.com/s/bqmnk1va9kbbn_7-crz-pq